La
Asamblea Nobel del Instituto Karolinska ha concedido
el Premio Nobel de Medicina a la bioquímica de origen húngaro y al inmunólogo
estadounidense, por sus descubrimientos sobre las modificaciones de las bases
de nucleósidos, que hicieron posible el desarrollo rápido de las vacunas ARNm
contra el coronavirus.
El jurado de los Nobel de este año ha considerado que los descubrimientos
de los dos premiados con el Nobel de Fisiología o Medicina 2023
“han sido fundamentales para desarrollar vacunas eficaces de ARNm contra la
covid-19 durante la pandemia que comenzó a principios de 2020”.
“Los revolucionarios descubrimientos de la bioquímica Katalin Karikó (Szolnok, Hungría 1955) y el inmunólogo Drew Weissman (Lexington,
EE UU, 1959) han cambiado radicalmente nuestra comprensión del modo en que
el ARNm interactúa con nuestro sistema inmunitario”, señala el comunicado de
los Premios Nobel.
Los galardonados, ambos investigadores de la Universidad de Pensilvania (EE UU),“contribuyeron
al ritmo sin precedentes de desarrollo de vacunas durante una de las mayores
amenazas para la salud humana de los tiempos modernos”, añaden estas fuentes.
Karikó y Weissman ya fueron ganadores del Premio Princesa de Asturias de
Investigación (2021) y del Premio Fundación BBVA Fronteras
del Conocimiento en Biología y Biomedicina (2022), donde
también se reconoció su aportación al desarrollo de vacunas contra el
coronavirus
Vacunas antes de la pandemia
La vacunación estimula la formación de una respuesta
inmunitaria frente a un agente patógeno concreto. Esto da al
cuerpo una ventaja en la lucha contra la enfermedad en caso de una exposición
posterior. Desde hace tiempo existen vacunas basadas en virus muertos o
debilitados, como las de la poliomielitis, el sarampión y la fiebre amarilla.
En 1951, Max Theiler recibió el Premio Nobel de Fisiología
o Medicina por desarrollar la vacuna contra la fiebre amarilla.
Gracias a los avances de la biología molecular en las últimas décadas, se
han desarrollado vacunas basadas en componentes virales individuales, en lugar
de virus enteros. Partes del código genético viral,
que suelen codificar proteínas que se encuentran en la superficie del virus, se
utilizan para fabricar proteínas que estimulan la formación de anticuerpos
bloqueadores del virus.
Ejemplos
de ello son las vacunas contra el virus de la hepatitis B y el virus del
papiloma humano. Otra posibilidad es trasladar partes del código genético viral
a un virus portador inofensivo, un ‘vector’. Este método se utiliza en las
vacunas contra el virus del Ébola. Cuando se inyectan vacunas vectoriales, la
proteína vírica seleccionada se produce en nuestras células, estimulando una
respuesta inmunitaria contra el virus objetivo.
ARNm: una idea prometedora
En nuestras células, la información genética codificada en el ADN se
transfiere al ARN mensajero (ARNm), que se
utiliza como molde para la producción de proteínas. En la década de 1980 se
introdujeron métodos eficaces de producción de ARNm sin cultivo celular,
denominados transcripción in vitro.
Este paso
decisivo aceleró el desarrollo de las aplicaciones de la biología molecular en
varios campos. También despegaron las ideas de utilizar las tecnologías de ARNm
para vacunas y fines terapéuticos, pero aún quedaban obstáculos por superar.
El ARNm transcrito in vitro se
consideraba inestable y difícil de administrar, lo que exigía el desarrollo de
sofisticados sistemas lipídicos portadores para encapsular el ARNm. Además,
provocaba reacciones inflamatorias. Por tanto, el entusiasmo por desarrollar la
tecnología del ARNm con fines clínicos fue inicialmente limitado.
El gran avance
Karikó y Weissman observaron que las células dendríticas reconocen el ARNm transcrito in vitro como una
sustancia extraña, lo que provoca su activación y la liberación de moléculas de
señalización inflamatoria.
Se
preguntaron por qué este ARNm era reconocido como extraño mientras que el
procedente de células de mamífero no daba lugar a la misma reacción. Ambos
investigadores se dieron cuenta de que algunas propiedades críticas debían
distinguir los distintos tipos de ARN mensajero.
El ARN contiene cuatro bases, abreviadas A, U, G y C, que corresponden a A,
T, G y C en el ADN, las letras del código genético. Karikó y Weissman sabían
que las bases del ARN de células de mamíferos suelen estar químicamente
modificadas, mientras que el ARNm transcrito in vitro no lo
está.
Entonces, se cuestionaron si la ausencia de bases alteradas en el ARN
transcrito in vitro podría explicar la
reacción inflamatoria no deseada. Para investigarlo, produjeron diferentes
variantes de ARNm, cada una con alteraciones químicas únicas en sus bases, que
administraron a células dendríticas.
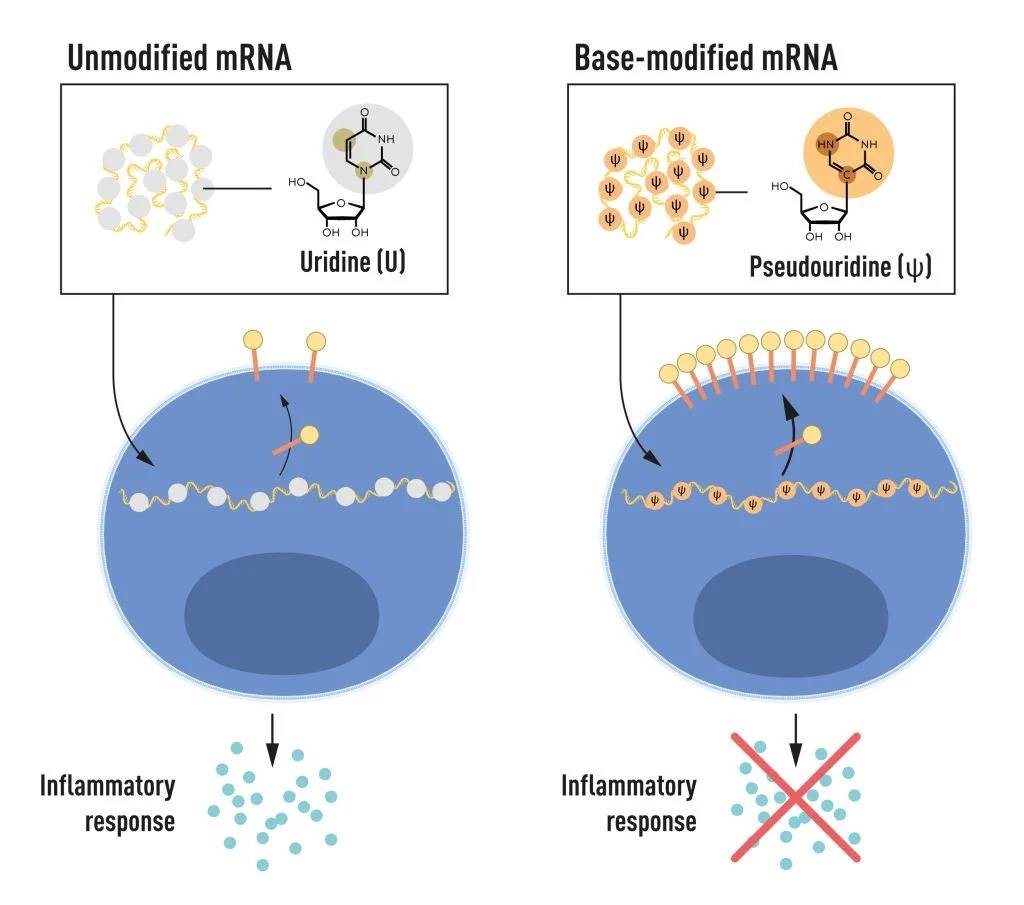
Los
resultados fueron sorprendentes: la respuesta inflamatoria casi desaparecía
cuando se incluían modificaciones en las bases del ARNm. Esto supuso un cambio
de paradigma en nuestra comprensión de cómo las células reconocen y responden a
diferentes formas de ARNm.
Karikó y Weissman comprendieron de inmediato que su descubrimiento tenía un
profundo significado para el uso del ARNm como terapia.
Estos resultados fundamentales se publicaron en 2005, quince años antes de la
pandemia del coronavirus.
En estudios posteriores publicados en 2008 y 2010, los dos investigadores
demostraron que la administración de ARNm generado con modificaciones de bases
aumentaba notablemente la producción de proteínas en comparación con el ARNm no
modificado. El efecto se debía a la menor activación de una enzima que regula
la producción de proteínas. Gracias a sus descubrimientos de que las
modificaciones de las bases reducían las respuestas
inflamatorias y aumentaban la producción de proteínas, Karikó y
Weissman habían eliminado obstáculos críticos en el camino hacia las
aplicaciones clínicas del ARNm.
El ARNm contiene cuatro bases diferentes abreviadas: A, U, G y C. Los galardonados descubrieron que el ARNm con bases modificadas puede utilizarse para bloquear la activación de reacciones inflamatorias (secreción de moléculas señalizadoras) y aumentar la producción de proteínas cuando el ARNm se administra a las células. / © Comité Nobel de Fisiología o Medicina. / Mattias Karlén
El ARNm contiene cuatro bases diferentes abreviadas: A, U, G y C. Los
galardonados descubrieron que el ARNm con bases modificadas puede utilizarse
para bloquear la activación de reacciones inflamatorias (secreción de moléculas
señalizadoras) y aumentar la producción de proteínas cuando el ARNm se
administra a las células. / © Comité Nobel de Fisiología o Medicina. / Mattias
Karlén
El verdadero potencial de las vacunas ARNm
El interés
por la tecnología del ARNm empezó a repuntar y, en 2010, varias empresas
trabajaban en el desarrollo del método. Se buscaban vacunas contra el virus del
Zika y el MERS-CoV; este último está estrechamente relacionado con el
SARS-CoV-2.
Tras el
brote de la pandemia de covid-19, se desarrollaron a una velocidad récord dos
vacunas de ARNm modificado con bases que codificaban la proteína de superficie
del SARS-CoV-2. Se notificaron efectos protectores de alrededor del 95 %, y
ambas vacunas fueron aprobadas ya en diciembre de 2020.
La
impresionante flexibilidad y rapidez con que pueden desarrollarse las vacunas
de ARNm allanan el camino para utilizar la nueva plataforma también para
vacunas contra otras enfermedades infecciosas. En el futuro, la tecnología
también podrá utilizarse para administrar proteínas terapéuticas y tratar
algunos tipos de cáncer.


No hay comentarios:
Publicar un comentario