Investigadores españoles y alemanes han ideado un mecanismo para llevar agentes bioactivos al interior de la célula utilizando unos compuestos de boro que son capaces de desordenar las moléculas de agua y deshidratar la carga que llevan. De esta forma pueden atravesar la membrana celular sin dañarla y entregar el cargamento, lo que puede resultar de gran interés para administrar fármacos.
Uno de los grandes retos en el diseño de fármacos es introducir en la célula moléculas que sean
solubles en agua, pues la membrana celular supone una barrera semipermeable que este
tipo de sustancias no pueden atravesar fácilmente. Para superarla, los expertos vienen
empleando distintos vehículos artificiales como polímeros, lípidos y algunos tipos de péptidos
que consiguen llevar su carga al interior celular con éxito.
Hasta la fecha, todos estos portadores tienen una estructura anfifílica (con un extremo afín
al agua y el otro a los lípidos), lo que les permite enmascarar de manera transitoria su carga
en un envoltorio hidrófobo para abrirse paso a través de la membrana lipídica. Pero esta
estrategia tiene sus limitaciones: en ocasiones, este mismo comportamiento puede
dañar la membrana, y en otros casos los compuestos anfifílicos muestran poca solubilidad,
lo que puede limitar su efectividad.
Estos compuestos de boro tienen propiedades supercaotrópicas que les permite desordenar
las moléculas de agua y deshidratar la carga que llevan, para así poder atravesar la
membrana celular y entregarla
Ahora investigadores del Centro Singular de Investigación en Química Biolóxica y Materiais
Moleculares (CiQUS) de la Universidad de Santiago de Compostela, en colaboración con
científicos de la Universidad Jacobs de Bremen (Alemania), han desarrollado una nueva
clase de vehículos moleculares para administrar fármacos que trasciende el dogma anfifílico.
El avance lo publican en un articulo de acceso abierto en Nature.
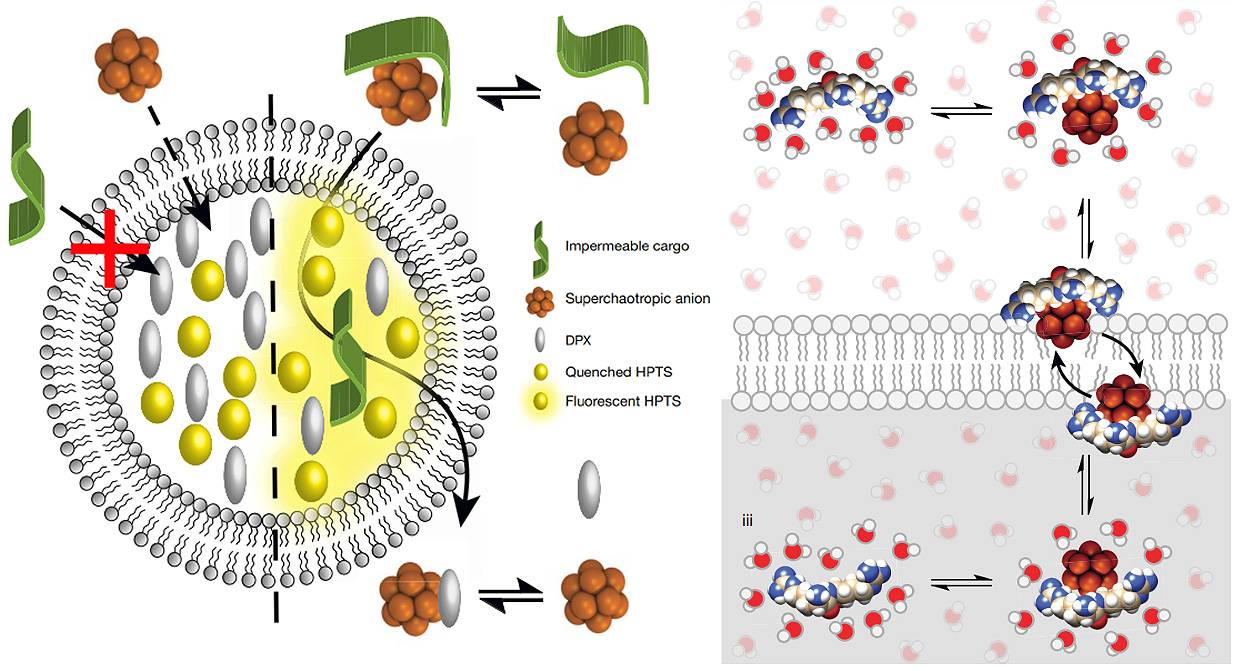
Los nuevos portadores son clústeres o conjuntos de átomos de boro con forma esférica,
carga negativa y una excelente solubilidad en el agua. La clave reside en su naturaleza
supercaotrópica, una propiedad que les permite desordenar las moléculas de agua y
deshidratar así la carga que transportan para poder atravesar la membrana hidrófoba.
“Hemos identificado una clase completamente nueva de vehículos que podrían ser utilizados
para llevar distintos fármacos al interior de las células. Los aniones supercaotrópicos son
una nueva herramienta, totalmente diferente a las que había hasta la fecha, para poder
internalizar sustancias hidrófilas en la célula cuyo potencial justo se acaba de
empezar a explorar”, destaca Guilia Salluce del CiQUS, una de las dos primeras coautoras
del estudio.
Javier Montenegro y Giulia Salluce, dos de los investigadores que han participado en el estudio
. / CiQUS
Por su parte, el grupo alemán, que dirige el profesor Werner Nau, ha estudiado el
comportamiento de estos cúmulos de boro, junto a otros átomos (como el hidrógeno,
el cloro, el bromo...), en modelos de membranas basados en vesículas artificiales.
Candidato óptimo de boro y bromo
En particular, se ha comprobado que un compuesto de boro y bromo (B12Br122- )
es el candidato óptimo de esta nueva clase de portadores de boro supercaotrópicos.
Interactúa con las moléculas a transportar de una manera totalmente novedosa,
sin necesidad de agregarse con ella o tener que encapsularla.
Hemos identificado una clase completamente nueva de vehículos que podrían ser utilizados
para llevar distintos fármacos al interior de las células
“Los nuevos vehículos tienen unas propiedades de transporte muy particulares”, comenta
Andrea Barba-Bon, investigadora del equipo alemán y la otra coautora del estudio,
“a diferencia de los tradicionales compuestos anfifílicos, el orden en que se añaden
los clústeres y las moléculas que queremos transportar a las vesículas, o incluso
el tipo de membrana, tienen un efecto mínimo sobre su efectividad”.
La nueva estrategia sirve para administrar con gran eficiencia una amplia variedad
de sustancias bioactivas, desde pequeñas moléculas a péptidos de mayor tamaño.
Estos complejos de boro pueden transportarlas con éxito al interior de células vivas,
como ha demostrado el grupo del ICFO, liderado por el profesor Javier Montenegro.
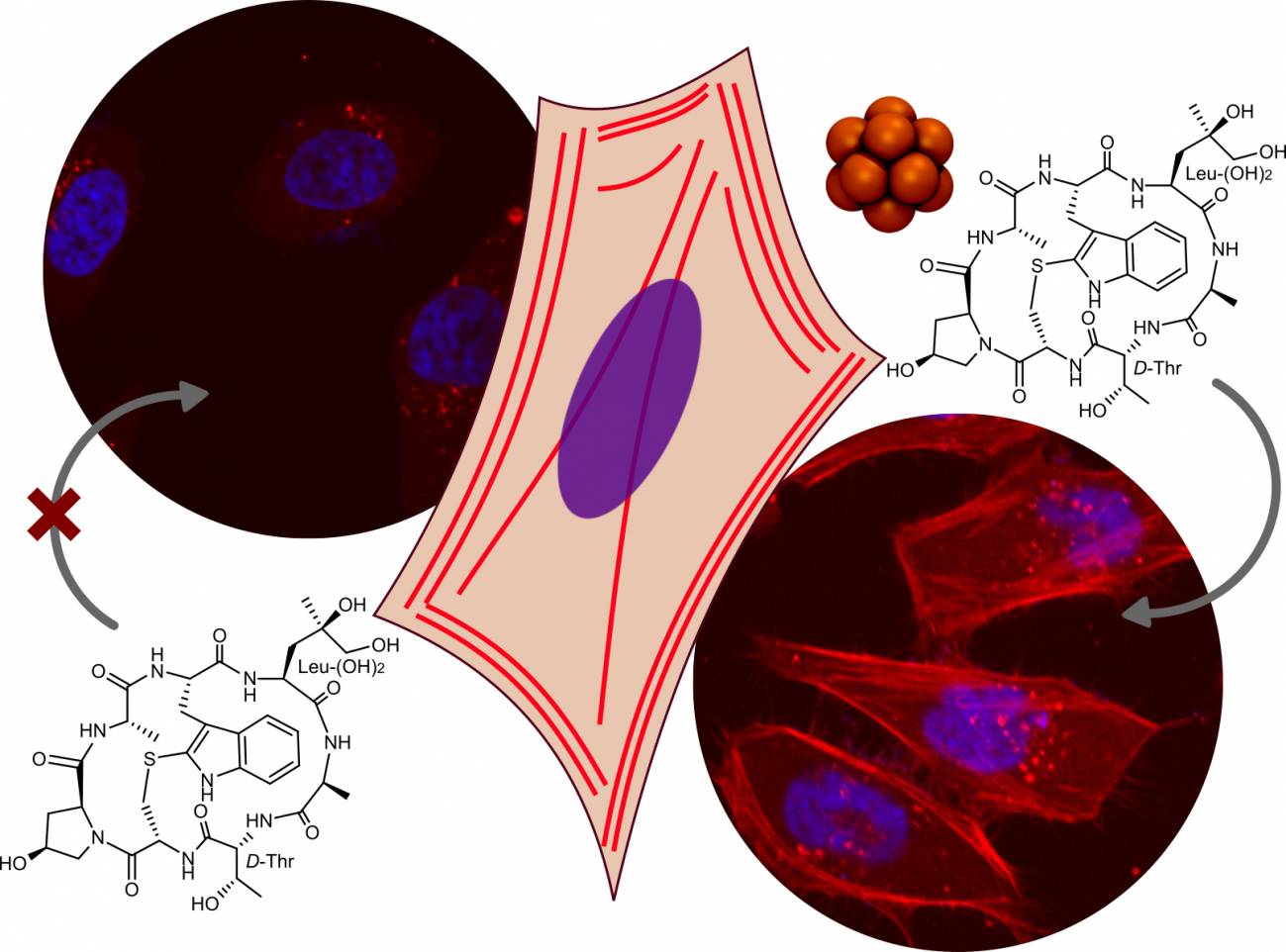
Los investigadores del centro gallego han conseguido llevar diferentes cargas hidrofílicas
al interior de las células, incluyendo la faloidina –una molécula empleada habitualmente
como marcador bioquímico del citoesqueleto– hasta el citosol en el interior celular, y teñir
de este modo el esqueleto intracelular de distintos tipos de células.
Los investigadores del CiQUS han llevado diferentes cargas hidrofílicos al interior de las células,
incluyendo la faloidina, una molécula empleada habitualmente como marcador bioquímico de
l citoesqueleto. / Montenegro Lab.
“Anticipamos que el amplio y distinto espectro de entrega de nuestros portadores
supercaotrópicos será el punto de partida de estudios celulares-biológicos, neurobiológicos,
fisiológicos y farmacéuticos conceptualmente distintos”, concluyen los autores en su artículo.
Referencia:
Andrea Barba-Bon, Guilia Salluce et al.“Boron Clusters as Broadband Membrane Carriers”.
Nature, 2022.

Guilia Salluce (CiQUS)
 Fuente: CiQUS
Fuente: CiQUSDerechos: Creative Commons.
No hay comentarios:
Publicar un comentario